Химия
Химическая связь
План урока:
Словно компоненты конструктора, атомы соединяются между собой. И как бы, Вы не старались, но с единичным блоком можно соединить, только один блок. Деталь на 4 ячейки, может удержать не больше четырёх. Этот принцип сохраняется и в химии. За количество свободных ячеек отвечает валентность атомов элементов.
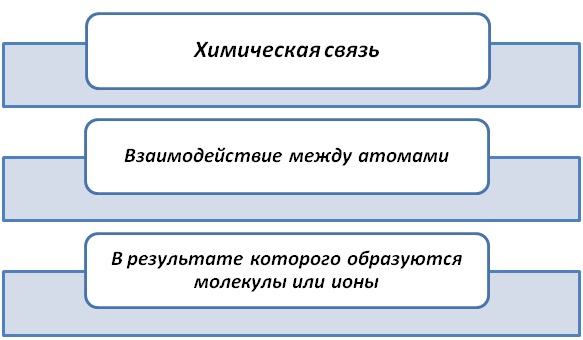
Результатом взаимодействия атомов является получение веществ. Виды химической связи атомов зависят от природы составляющих элементов.
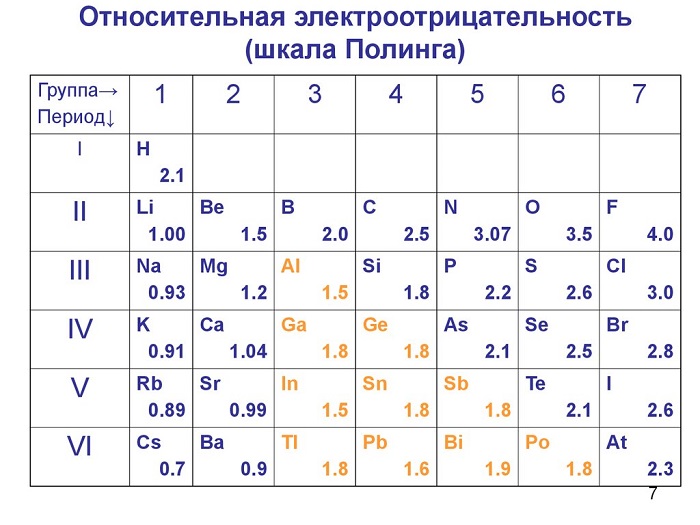
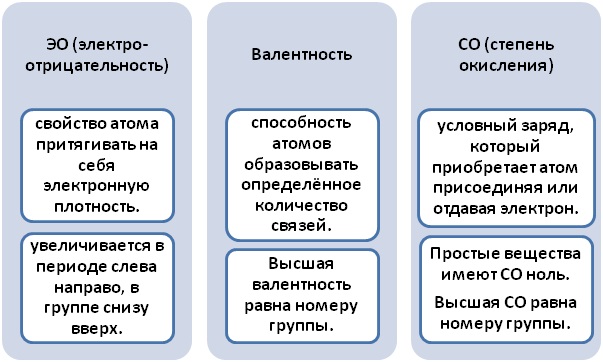
Металлы отличаются малым количеством электронов на внешнем уровне сравнительно с неметаллами более низким значением электроотрицательности. Теперь наша задача вспомнить, как происходит изменение ЭО в таблице Менделеева или воспользоваться таблицей «Относительная электроотрицательность». Чем активнее неметалл, тем она выше и это говорит о том, что этот элемент, при образовании связи, будет забирать электроны.
Веществ насчитывается миллионы. Это могут быть простые вещества: металлы железо Fe, золото Au, ртуть Hg; неметаллы сера S, фосфор Р, азот N2. Так и сложные вещества: H2S, Ca3(PO4)2, (C6H10O5)n, молекулы белков и т.д.Комбинация элементов, входящих в состав веществ, определяет какие типы связей будут существовать между ними.
Ковалентная связь
Неметаллы из числа всех элементов находятся в меньшинстве. Но имея некоторые особенности в строении и способности иметь переменную валентность, число соединений, построенных этими элементами внушительное.
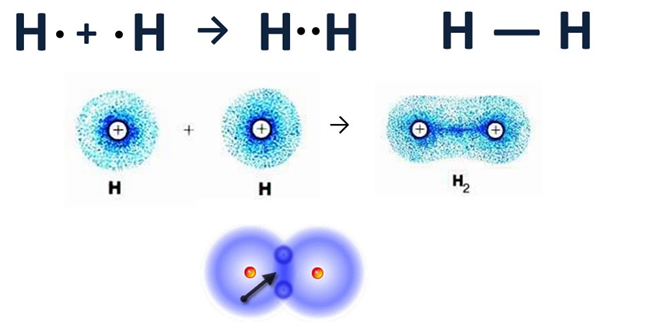
Чтобы иметь представление, по которому атомы соединяются, начнём с молекулы водорода Н2.
Давайте дадим волю фантазии, представим то, что нельзя увидеть. Допустим, что мы взяли в руки две одинаковые детали, имеющие такой вид:

Существует одна только комбинация их соединения, и между ними будет одно общее звено. Переместимся с нашего воображения к молекулам. Представим, что перед нами, два атома водорода и наша задача их соединить в молекулу. Покрутите мысленно детали, чтобы они объединились, необходимо их поставить друг на друга, связав их в определённом месте. Точки рядом означают, сколько электронов, располагающихся на наружном слое.
Источник
Атомы водорода, как детали, соединились одной связью, поэтому валентность в данном случае каждого из них будет равна I. Но степень окисления будет равна 0, так как вещество образовано элементом с одинаковым значением электроотрицательности.
Рассмотрим, как образуется молекула самого распространённого газа на нашей планете – азота N2.
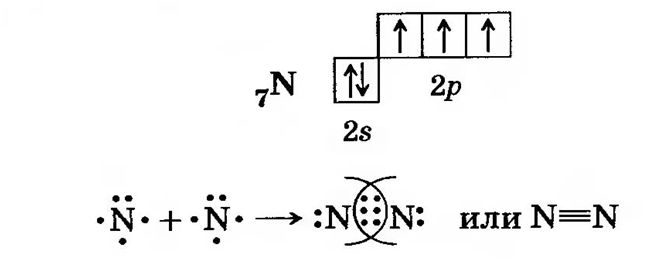
Азот, имеет 3 неспаренных электрона. Это как взять две детали вида и соединить их.

Таким образом, азот трёхвалентен, а степень
окисления по-прежнему остаётся равна 0. За счёт общей электронной пары азот завершает внешний слой 2s22p6.
Ковалентная связь в молекуле, состоящей из одного типа атомов, а именно неметаллов, носит название неполярная.
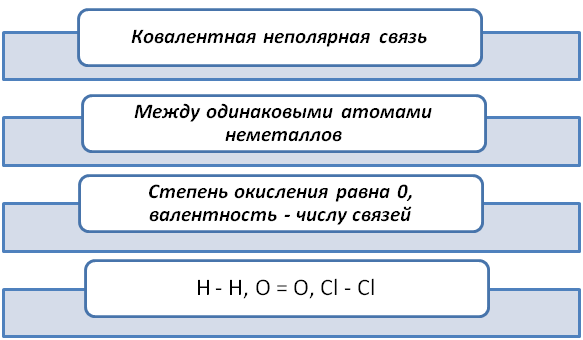
Во время построения молекулы, количество электронов стремится к завершению. Рассмотрим как образуется молекула О2. Каждому атому не хватает 2 электронов и они эту недостачу компенсируют общей электронной парой.
Также обращаем внимание, что степень окисления 0, ибо атомы равноправные партнёры, и их валентность равна II.
Ковалентная химическая связь образованная разными неметаллами называется полярная.
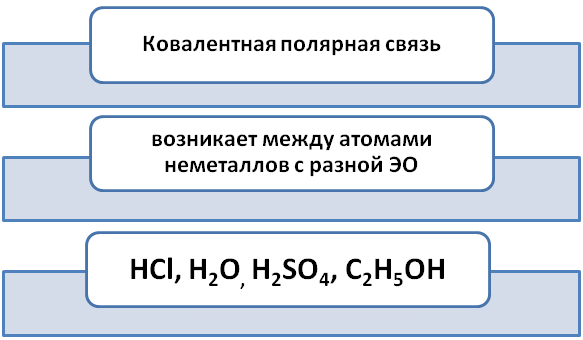
Возьмём два неметаллических элемента Водород и Хлор. Укажем электронные формулы внешнего слоя.
Н 1s1
Cl 3s2 3p5
Проанализировав значения, Э(Н) < Э(Cl), приходим к выводу, чтобы принять конфигурацию благородного газа, хлор будет притягивать на себя единственный электрон водорода.
Схема ковалентной связи, образованной разными элементами, записывается в таком виде.
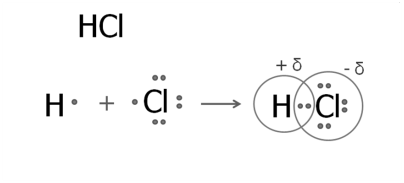
Столь важно отметить, что в этой ситуации Cl и Н не будут равноправными партнёрами, поскольку общая плотность электронов сосредоточена у Cl. Водород в неравном бою, уступает 1 электрон хлору, у которого в наличии их целых 7. Водород приобретает положительный заряд, хлор – отрицательный. Валентности Н и Cl равны I.В то время степени окисления будут Н+Cl−.
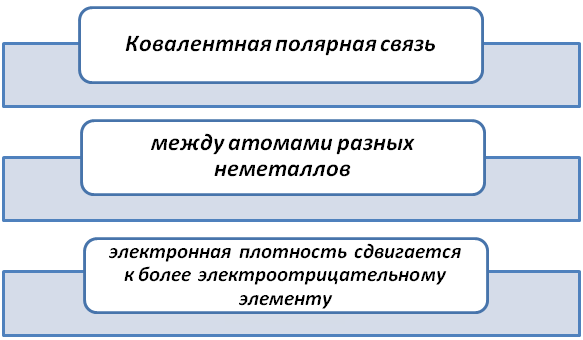
Такой вид образования соединений происходит по обменному механизму. Это значит, чтобы получить завершённую конфигурацию более электроотрицательные принимают электроны, менее – отдают, но при этом существует общая электронная пара.
Неметаллы образуют не только бинарные соединения, а возможно в состав будет входить три и более элемента. К примеру, молекула угольной кислоты H2СO3 состоит с 3 элементов. Как они между собой соединяться. Электроотрицательность возрастает в ряду ЭО (Н) <ЭО (С) <ЭО(O). Определим степени окисления каждого элемента. Н+2С+4О−23. Это означает, что кислород будет притягивать на себя электроны углерода и водорода. Схематически это можно записать в следующем виде.
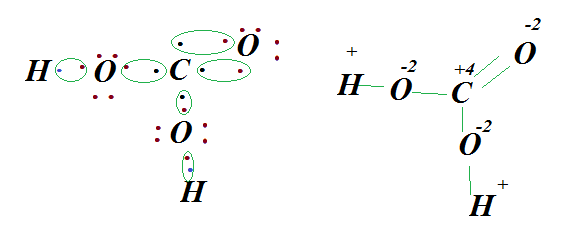
Чтобы построить структурную формулу, в центре записываем углерод. У него неспаренных 4 электрона. Поскольку атомов кислорода в количестве 3, каждый из них может принять 2 электрона. То путём не хитрых вычислений, видим что 4 электрона придёт от С и по одному от каждого Н. проверяем наш расчёт, учитывая нейтральность молекулы, считаем положительные и отрицательные заряды.
Н2+С+4О3−2 (+1 ∙ 2) + (+4 ∙ 1) + (-2 ∙ 3) = 0
Существует ещё один механизм ковалентной связи, под названием донорно-акцепторный.
Чтобы понять этот принцип, опишем образование молекулы, имеющей не совсем приятный резкий, удушающий запах, аммиак NH3.
H 1s1
N 2s2 2p3
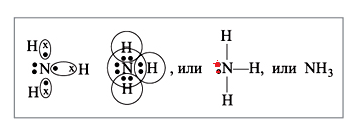
Из 5 электронов, находящиеся в распоряжении атома N, связываются только 3. Валентность атома N приобретает значение III. При этом степень окисления N−3 (оттянув на себя 3 электрона от каждого атома Н, становится отрицательным), водород, наоборот совершив «благородный поступок», отдав электрон, приобретает положительный заряд Н+. Два электрона никак не задействованы, они выделены красным цветом. Они способны поселиться в свободной ячейке иона Н+. Это место займут электроны азота, которые обозначены красным цветом. Образуется катион аммония по донорно-акцепторному механизму.

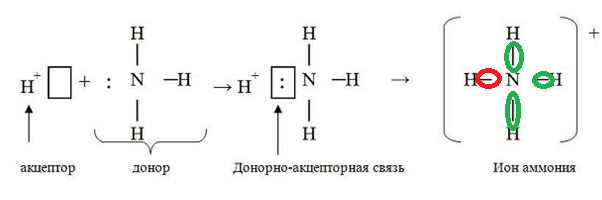
Незадействованные до этого «красные» электроны N «заселяются» в пустой s-орбитали, принадлежащей катиону водорода. Ион аммония имеет 3 связи, которые происходят по обменному механизму, а также одну, по донорно-акцепторному. Именно поэтому NH3 легко взаимодействует с кислотами и водой.
Ионная связь
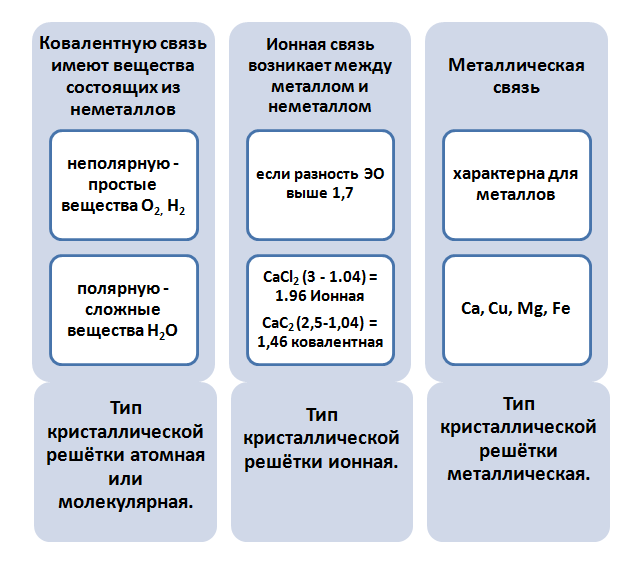
Ионная химическая связь является пограничной ковалентной полярной. Отличаются тем, что для веществ, в которых локализуется ковалентная связь, характерно существование совместной электронной пары, тогда как для ионной связи свойственна полная отдача электронов. Следствием отдачи является образование заряженных частиц – ионов.
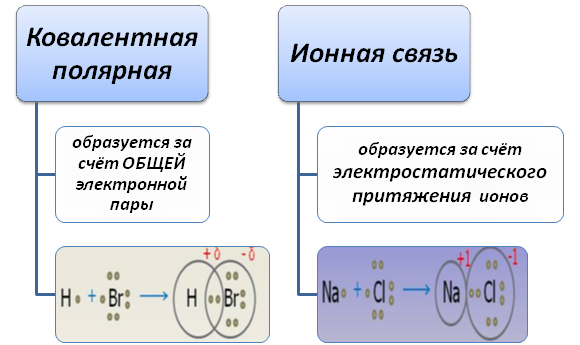
Определить тип связи помогут вычисления. Если разность значений электроотрицательностей больше 1,7, то для вещества характерна ионная связь. Если значение меньше 1,7, то свойственная полярная связь. Рассмотрим два вещества NaCl и СаС2. Оба они образованы металлом (Na и Са) и неметаллом (Clи С). Однако в одном случае связь будет ионная, во втором – ковалентная полярная.

Постулат физики гласит, что противоположности притягиваются. Т.е. положительные ионы притягивают отрицательные и наоборот.

Допустим, что необходимо получить вещество с атомов калия и фтора. Каждый атом стремится заполучить конфигурацию благородного газа. Достигнуть этого возможно двумя способами отдав или приняв электроны, образуя при этом ионы с желаемой конфигурацией.
Атому калия гораздо проще отдать 1 электрон, чем забрать у фтора 7. Принимая 1 электрон, F имеет завершённый уровень.
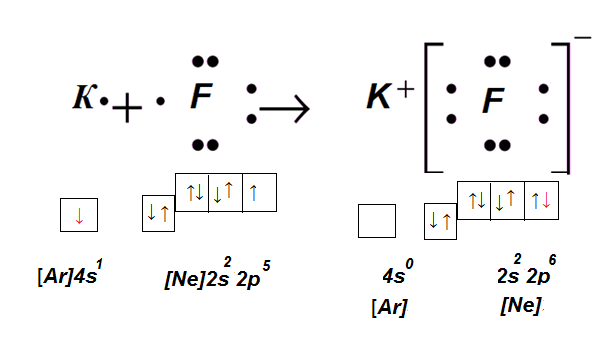
Аналогично калий, который с лёгкостью отдал свой электрон, его катион принял электронную формулу аргона.
Кальций двухвалентный металл, то для взаимодействия необходимо два атома фтора, поскольку он способен принять только один электрон. Схема образования ионной связи имеет вид.
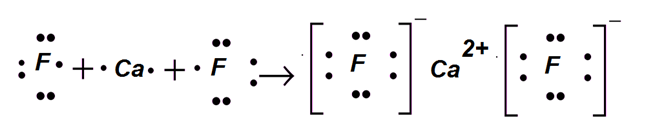
Данный вид связи локализуется во всех солях, между металлом и кислотным остатком. В выше приведённом примере для угольной кислоты, кислотным остатком будет СО32−, если вместо водорода поставить атомы натрия, то схема образования связи имеет вид.
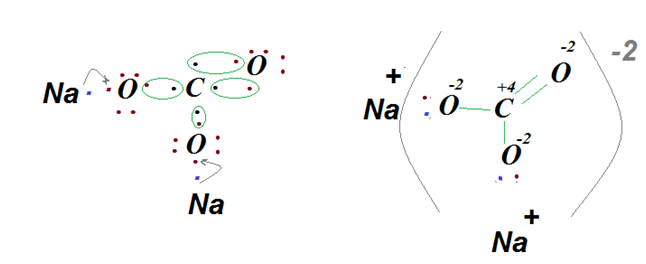
Следует отметить, что ионная связь будет существовать между Naи О, а между С и О ковалентная полярная.
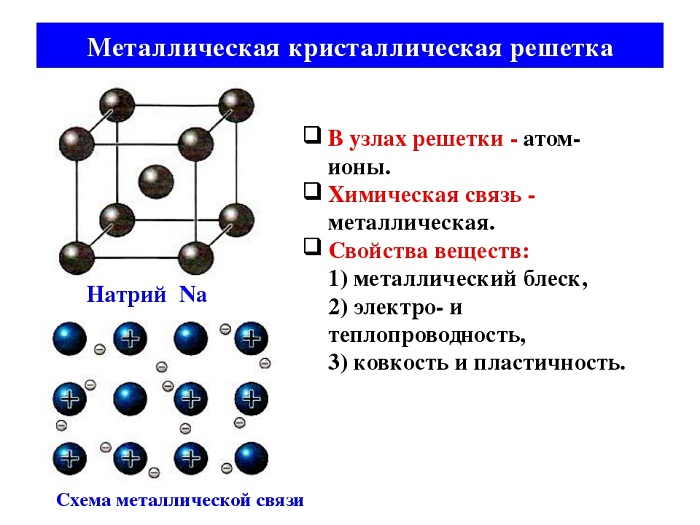
Металлическая связь
Металлы существуют в разных цветах: чёрные (железо), красные (медь), жёлтые (золото), серые (серебро), плавятся при разных температурах. Однако их всех объединяет наличие блеска, твёрдости, электропроводимости.
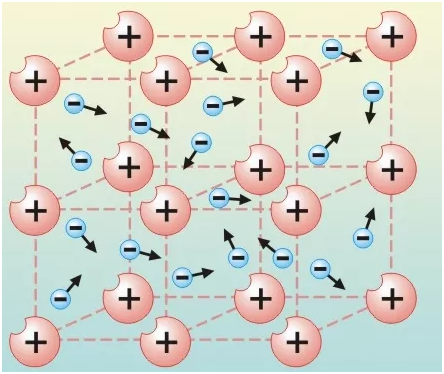
Металлическая связь имеет черты сходства с ковалентной неполярной. Металлы бедны электронами на внешнем уровне, поэтому при образовании связи, они не способны притягивать на себя их, для них свойственна отдача. Так как атомный радиус в металлах большой, это даёт возможность легко оторваться электронам, образовав катионы.
Me0 - ne = Men+
Электроны постоянно перемещаются от атома к иону и наоборот. Сами катионы можно сравнить с айсбергами, окружёнными отрицательными частицами.
Схема металлической связи

Водородная связь
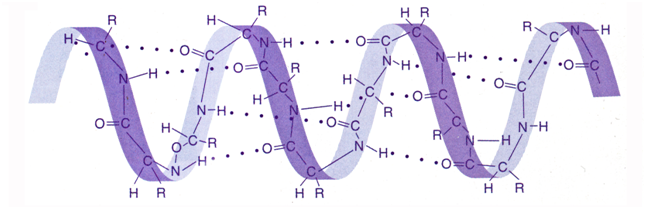
Элементы-неметаллы II периода (N, O, F) обладают высоким значением электроотрицательности. Это влияет на способность образования водородной связи между поляризованным Н+ одной молекулы и анионом N3-, O-2, F-. Водородная связь способна объединить две разные молекулы. К примеру, если взять две молекулы воды, то они соединяются между собой за счёт атомов Н и О.
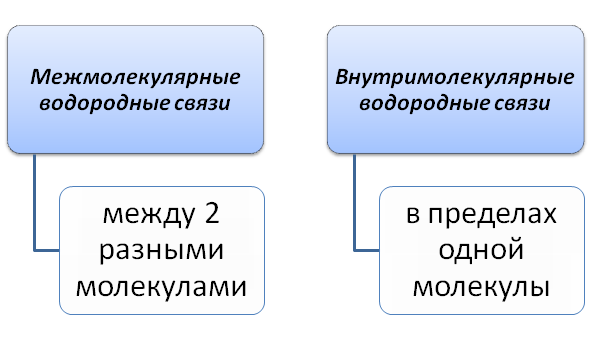

Водородная химическая связь изображена …… пунктиром. Соединяясь между собою молекулы, играют и находят важную роль в живых организмах. С помощью водородной связи строится вторичная структура молекулы ДНК.
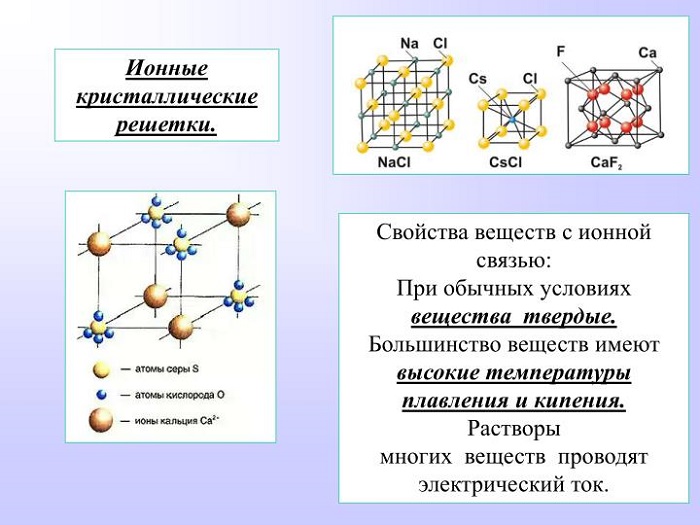
Типы кристаллических решёток
Чтобы получить вещество, а не просто набор молекул, необходимо частицы «запаковать» в своеобразный каркас – кристаллическую решётку.
Представьте перед собой геометрическую фигуру – куб, в вершинах будут находиться частицы, условно соединённые между собою.
Существует прямая зависимость между строением атома и типом кристаллической решётки.

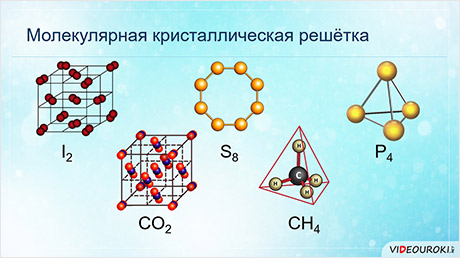
Обратите внимание, что соединения с ковалентной неполярной связью образованные частицами-молекулами, которые запакованы в молекулярную кристаллическую решётку. Чаще всего это будут соединения по температурному режиму низкокипящие и летучие. Это известные вам вещества как кислород О2, хлор Cl2, бром Br2.
Ковалентная полярная химическая связь также характерна для молекулярных соединений. Сюда входят как органические: сахароза, спирты, метан так и неорганические соединения: кислоты, аммиак, оксиды неметаллов. Существование их бывает как в жидком (Н2О), твёрдом (сера) так и газообразном виде (СО2).
В узлах атомной кристаллической решётки находятся отдельные атомы, между которыми существует ковалентная неполярная связь. Атомная кристаллическая решётка свойственна алмазу. На данный момент это самое твёрдое вещество. Данный тип связи характерен для вещества, покрывающего значительную часть нашей планеты, это –SiO2 (песок) и карборунд SiC, имеющий похожие свойства с алмазом.
Ионная связь между атомами образует кристаллическую решётку, в узлах которой будут находиться катионы и анионы. Это строение объединяет между собой целый класс неорганических соединений солей, состоящих с катионов металлов и анионов кислотного остатка. Характерными особенностями этих веществ будут высокие температуры, при которых они плавятся и кипят.
Металлическая связь имеет металлическую кристаллическую решётку. В её строении можно провести параллель с ионной решёткой. В узлах будут размещаться атомы и ионы, а между ними электронный газ, состоящий из мигрирующих электронов от атома к электрону.
Обобщая данные сведения, можем сделать вывод, зная состав и строение, можем прогнозировать свойства и наоборот.
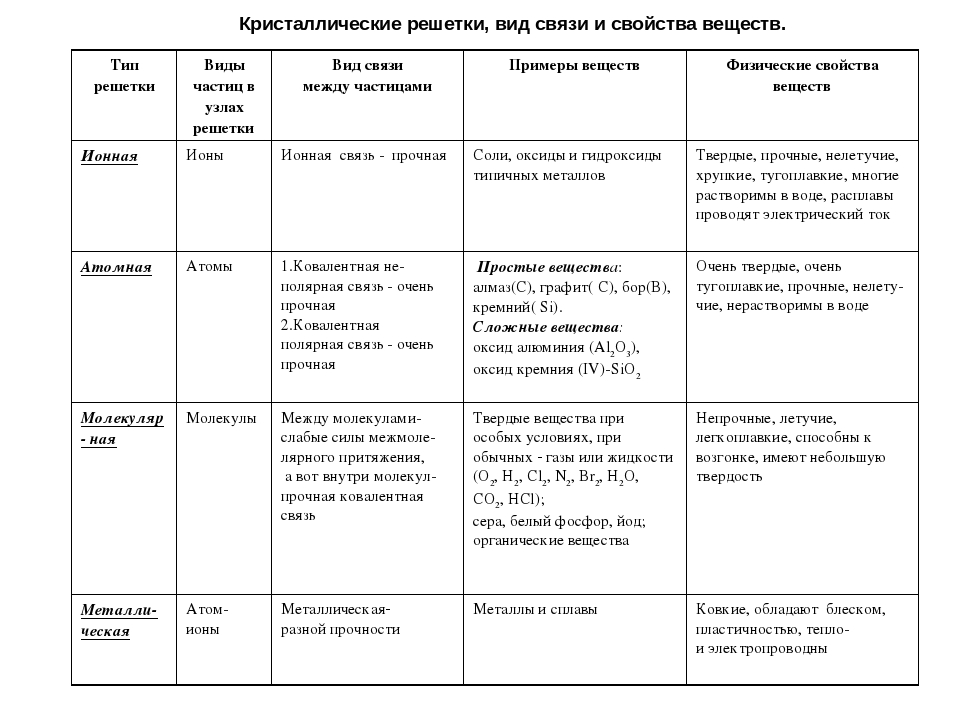
Итак, из вышесказанного сделаем вывод.
ВОПРОСЫ И ЗАДАНИЯ
Ковалентную связь имеет вещество, образованное элементами с зарядом ядра:
1) +3 и +6 2) +20 и +17 3) +8 и +16 4) +11 и +7
Ковалентная неполярная химическая связь локализуется в следующих веществах:
1) Cu, S8, O3 2) N2, Ca, P4 3) Cu, Br2, Na 4) Cl2, O2, C
Ковалентная полярная связь имеет место в молекулах:
1) H2O, Na2O, H2O2 2) H2S, SO2, PCl5 3) CaS, S8, N2 4) HF, K2S, CaH2
Примеры ионной связи отображаются в следующих формулах:
1) CO2, C2H4, NaCl 2) BeO, H2Se, K2S 3) AlCl3, MgS, NaF 4) NaOH, O3, CS2
Для каких веществ не характерна металлическая химическая связь:
1) C, P4, Br2 2) Ni, Cu, Zn 3) Po, Al, Ba 4) Fe, Au, Ag