Химия

Химическое равновесие
План урока:
Принцип деления на обратимые и необратимые процессы
Скорость химической реакции
Что скрывается под этим понятием. Вернёмся к забегу животных. К примеру, лев может пробежать 80 км за 1 час, а заяц, за этот же промежуток времени преодолеет всего лишь 72 км.
Если в физике мы оперируем расстоянием, которое пройдено за определённый промежуток времени (1 час), то в химии используем изменение концентрации за единицу времени.

Под концентрацией мы имеем в виду количество вещества (моль) в определённом объёме (литр). Данный вид концентрации носит название молярная и имеет размерность моль/л. Если добавить время прохождения реакции, а именно секунды, то получим размерность скорости реакции.
Величина скорости реакции описывает, как быстро происходит процесс образования продуктов реакции либо как быстро расходуются реагенты (эти процессы между собой связаны).
Теперь возникает закономерный вопрос, от чего же зависит скорость реакции.

Вернёмся к примеру с животными, победителем гонки будет гепард, его физические данные, строение его тела позволяет развивать максимальную скорость.

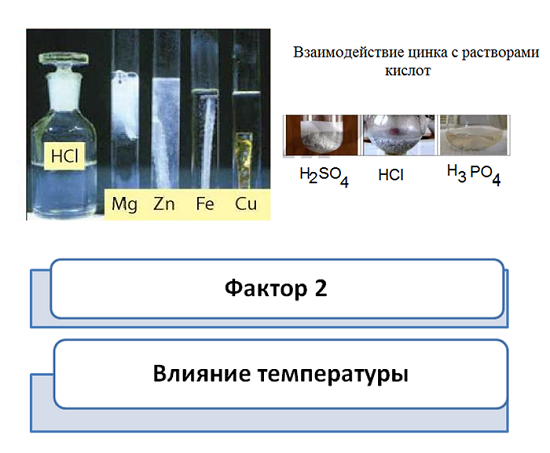
Так и в химии, скорость зависит от природы реагирующих веществ. Возьмём 4 металла – магний, железо, цинк и медь. Каждый с них будет реагировать с раствором соляной кислоты. Давайте попробуем предположить, как будет проходить опыт. Для этого используем ряд активностей металлов.

Быстрее всех прореагирует магний, на втором месте цинк, потом железо, а вот медь, в виду того, что это неактивный металл, совсем не реагирует.
Либо изменим условия опыта, три пробирки разных кислот, соляной, серной и ортофосфорной. И в каждую добавим цинк. Чем активнее кислота, тем быстрее она растворяет металл.
Второй фактор, который способен изменить скорость реакции – это влияние температуры.
Вспомним, в каком случае лучше растворяется сахар, в случае с холодным или горячим чаем. Экспериментально было замечено, что при повышении температуры реакция проходит быстрее. Причиной этому является увеличение скорости движения частиц. Эту закономерность нидерландский исследователь Вант-Гофф сформулировал в виде правила.

Расшифруем математическое выражение υ2 – эта время, за которое происходит реакция, после повышения температуры, соответственно, υ1 – это будет время до изменения. t2и t1– эта температура процесса.γ – это обозначение температурного коэффициента, который показывает во сколько раз увеличится скорость.
Рассмотрим это правило на примере такой реакции. Необходимо определить, во сколько раз возрастёт скорость реакции, если температуру повысили с 30°C до 90°C. Температурный коэффициент равен 2.5.
Дано:
t1 = 30°C
t2 = 90°C
γ = 2
Найти:
υ2/υ1 - ?
Решение.
Чтобы определить во сколько раз произойдёт быстрее реакция при более высокой температуре, воспользуемся правилом Вант-Гоффа.
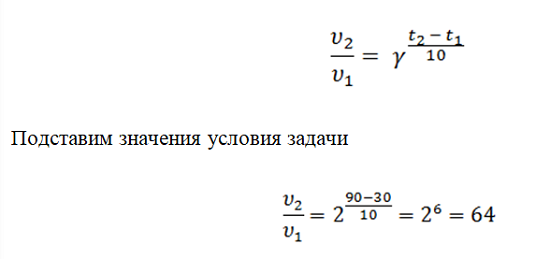
Т.е. если мы повысим температуру на 60°C, то это приведёт к увеличению скорости реакции, другими словами времени потребуется меньше, чтобы она произошла. Допустим, чтобы произошла реакция при 30°C необходимо 1,5 часа (90 минут). Этот же процесс при 90°C произойдёт за 1 минуту.

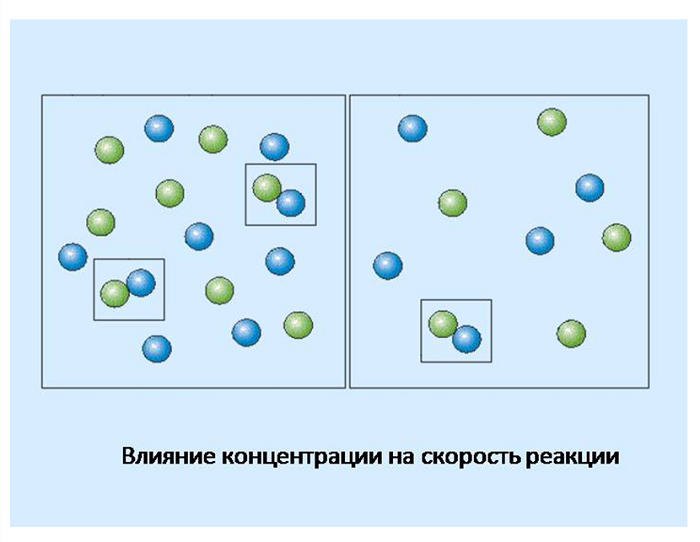
Рассмотрим, как влияет концентрация реагирующих веществ на скорость химического процесса. Здесь примером послужит следующая ситуация. Допустим, вам необходимо выйти на субботник и убрать территорию. Естественно, вы справитесь быстрее, если будет присутствовать весь класс, а не пару человек. Аналогично и в химии, чем выше содержание реагирующих веществ (концентрация), тем выше скорость реакции. Чем чаще частицы встречаются, тем выше вероятность образования нового вещества.

Ещё один фактор, который влияет на время реакции – это площадь соприкосновения реагентов. Снова представим утро за чашкой чая. В каком случае быстрее растает сахар в чае. В случае рафинада или песка? Чем больше площадь соприкосновения, тем скорость реакции выше. Поэтому перед проведением опытов рекомендуется измельчить реагенты.

А также следует отметить особые вещества, которые способны повлиять на скорость реакции – это катализаторы.

Перекись водорода, известна своими антибактериальными свойствами, разлагается с образованием воды и кислорода. Если же к этому раствору прибавить оксид марганца (IV) MnO2, то мы будем наблюдать бурно идущую реакцию. На рисунке изображена реакция разложения Н2О2.

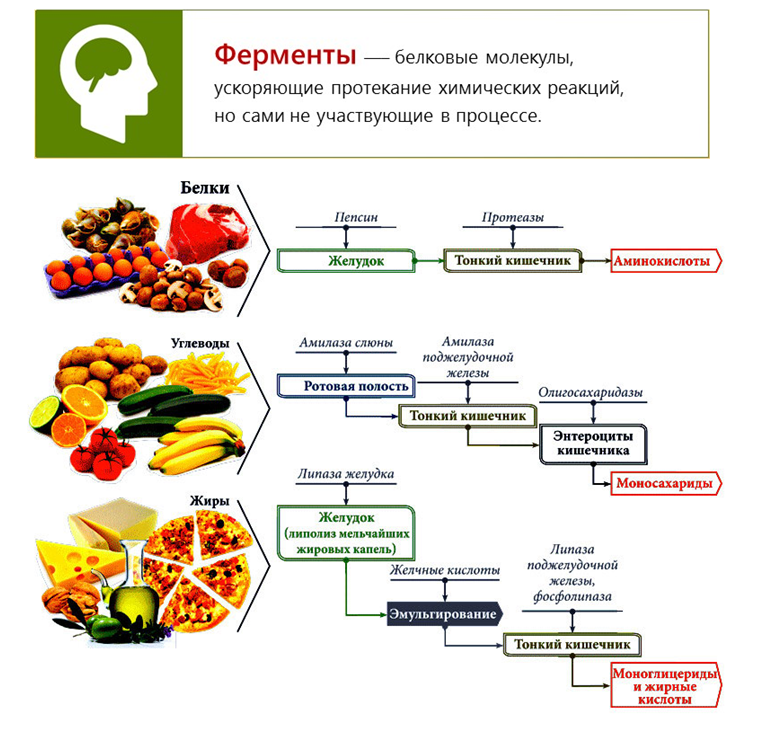
Каталитические реакции имеют место быть во многих химических процессах. Большинство процессов органического и неорганического синтеза не обходится без помощи катализатора. Это производство таких важных продуктов как серная и азотная кислоты, переработка нефтепродуктов. Также выделим природный катализатор, который вам известен как фермент.
Однако существует ряд химических процессов, которые не нуждаются в помощи катализатора – это некаталитические реакции. К данным процессам можно отнести реакции ионного обмена.
Хочется отметить, что не всегда необходимо ускорить процесс, а наоборот – замедлить его. Хочется замедлить процесс старения, окисления металлов. Для этого используют специальные вещества – ингибиторы.
Принцип деления на обратимые и необратимые процессы
Представьте себе лето, невыносимая жара, чтобы утолить жажду вы открываете бутылку холодной газированной воды.

Посмотрев на вещества, вы можете предположить, что происходит реакция между веществами. Уравнение реакции соединения имеет вид.
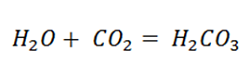
Однако, мы же ведь пьём газированную воду, а не углекислоту. Изучая тему, Электролитическая диссоциация, вы отмечали, что угольная кислота относиться к слабым электролитам и распадается с образованием СО2 и Н2О.
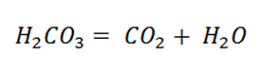
Т.е. одновременно происходит два процесса – это образование угольной кислоты и её разложение.
Как мы можем судить, что произошла химическая реакция? Нужно визуальное доказательство. Вот, к примеру, если добавить к раствору нитрата свинца (II) прибавить раствор йодида калия, мы можем наблюдать «золотой» осадок йодида свинца (II).

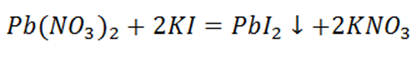
Обратившись к уроку Особенности протекания реакций в растворе, мы вспомним, ещё один признак реакции. Необратимо протекают реакции, результатом которых является выделение газа.
Если подействовать на сульфид натрия раствором сильной кислоты, то можно почувствовать неприятный запах тухлых яиц – это выделяется сероводород.
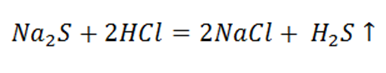
Также образование слабого электролита, в том числе и воды, является признаком необратимой реакции.
Что такое обратимые химические реакции, рассмотрим с помощью известной вам игры – перетягивание каната.
Если прямая и обратная реакция происходит с одинаковой скоростью, то наступает химическое равновесие. Вернёмся к канату, если силы будут равны, то перетянуть его в одну сторону достаточно сложно. Однако,добавление или уход участников приведёт к нарушению этого равновесия.
Химическое равновесие

Чтобы описать состояние равновесия воспользуемся законом действующих масс.

Допустим, что скорости как прямой, так и обратимой реакции равны.
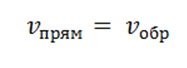
Вспомним канат, если силы равны, то возникает равновесие. Равновесие химических реакций можно выразить следующим образом, применив понятие константы равновесия, которая является мерой глубины прохождения реакции.
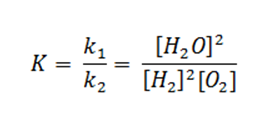
Однако равновесие в обратимых реакциях легко нарушить. Разберём с помощью каната, как его можно нарушить, т.е. сместить равновесие в ту или иную сторону.

Рассмотрим первый случай. Допустим, мы добавили в систему 2 моль водорода, как это повлияет на состояние равновесия.
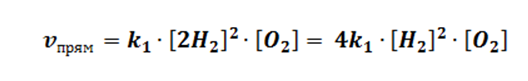
Путём математических вычислений, мы доказываем, что скорость прямой реакции взросла в 4 раза, значит, равновесие сместилось в сторону прямой реакции.
Проецируем данный пример на случай с канатом. Допустим, мы прибавили на одну из сторон 2 человека (в случае с задачей – моль), соответственно силы уже не равны, и побеждает та сторона, где участников процесса больше.

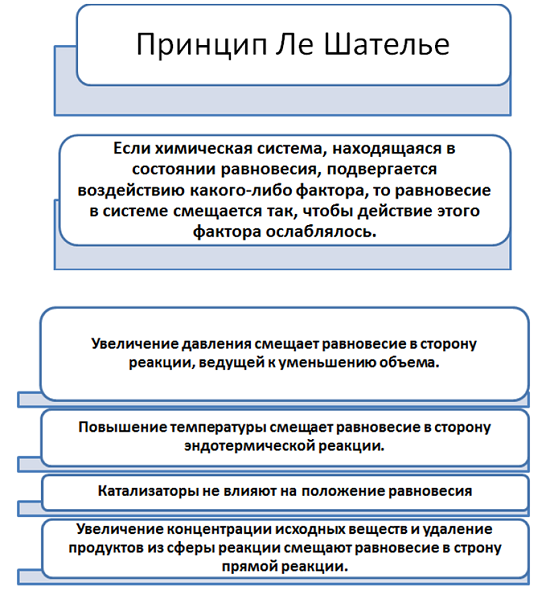
Влияние на химическое равновесие также оказывает температура. Как вам уже известно, реакции происходят либо с поглощением (эндотермические), либо выделением (экзотермические) тепла.
Химическая реакция соединения простых веществ водорода и кислорода, сопровождается выделением тепла. Если нагревать систему, то это приведёт к тому, что будет идти обратная реакция. Чтобы сместить равновесие вправо, необходимо наоборот охлаждать систему.
Логично предположить, чтобы сместить равновесие реакции с поглощением тепла, необходимо нагреть систему.
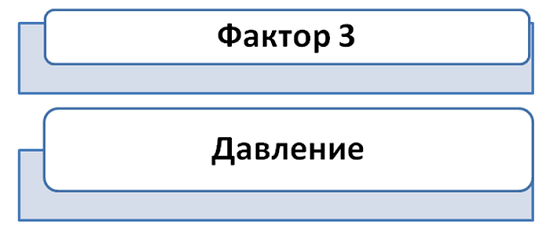
Давление также способствует нарушению равновесия, однако влияние идёт только на те соединения, которые находятся в газообразном состоянии.
Вспомним, что происходит с газами, если увеличить на них давление. Для этого представим воздушный шарик или мяч, который мы сильно сжимаем руками. Вследствие сжатия, его объём уменьшается, что приводит к увеличению содержания вещества.
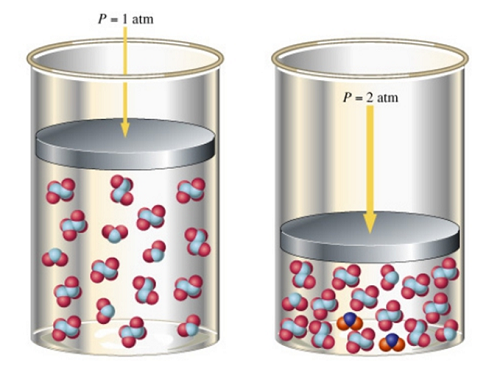
В реакции образования воды реагирует три моль газов (2 моль Н2 и 1 моль О2) и образуется 2 моль газа (2Н2О). В данном случае, равновесие сместится в сторону получения Н2О.
Всё выше сказанное, относительно равновесия в химических системах, французский учёный ЛеШателье объединил в постулат.
ВОПРОСЫ И ЗАДАНИЯ
Реакция замещения какого металла с раствором соляной кислоты происходит с наибольшей скоростью:
1) Cu 2) Mg 3) Fe 4) Pb
Как изменится скорость химической реакции (γ = 2,5) при понижении температуры на 40 °C?
1) Увеличится в 100 раз 2) Уменьшиться в 39 раз 3) Увеличится в 39 раз 4) Никаких изменений не произойдёт.
Укажите необратимые процессы (несколько ответов):
1) AgNO3 + NaCl→AgCl + NaNO3 2) Ba(OH)2 + 2NaCl → BaCl2 + 2NaOH 3) Ba(OH)2 + 2HCl → BaCl2 + 2H2O 4) AgNO3 + HBr→AgBr + HNO3
Используя принцип ЛеШателье, укажите процессы, в которых происходит смещение равновесия в сторону реагентов (обратной реакции) при повышении температуры (два ответа)
1) N2 + O2↔ 2NO – Q 2) C2H4↔ 2C + 2H2 + Q 3) 2SO2 + O2↔ 2SO3 + Q 4) CaCO3↔CaO + CO2 – Q
Во сколько раз необходимо увеличить давление системы, чтобы скорость химической реакции 2СО + О2 = 2СО2 взросла в 8 раз
1) 4 2) 3 3) 2 4) 8



