Химия

Алканы
План урока:
Распространение углеводородов
Углеводороды содержатся везде: от недр земли до атмосфер других планет. Например, в атмосферах Юпитера, Сатурна, Урана и Нептуна присутствует метан. Помимо планет, углеводороды содержатся в других космических объектах, например в хвостах комет и метеоритах.
Алканы
Алканы – это углеводороды, в которых все связи одинарные. Также их называют предельными (или насыщенными) углеводородами.
Все атомы углерода находятся в sp3-гибридизации.
Чтобы указать элементарный состав алканов, используют общую формулу: CnH2n+2 .
Для примера рассмотрим, каким образом можно записать несколько элементарных формул, в которых 1,2 и 3 атомов углерода.
Пользуясь выражением CnH2n+2, запишем:

Рисунок 1 – Гибридизация алканов
Следует заметить, что у алканов наблюдается структурная изомерия:

Номенклатура алканов
Номенклатура – это правило, по которому даются названия органическим веществам.
Для того, чтобы назвать молекулу органического вещества, необходимо учесть длину углеродной цепи, наличие кратных связей в молекуле, количество заместителей и их состав, а также наличие функциональных групп.
Заместители могут быть представлены атомами галогенов (хлор, бром, иод, фтор) или углеводородной частицей, которую называют «радикалом».
Понятие радикала
Радикал – углеводородная частица, в которой 1 из атомов углерода содержит 1 неспаренный электрон. Этот неспаренный электрон может образовать связь с углеродной цепочкой, функциональной группой или другим атомом. Для записи радикала используют символ: R, и в общем случае называют алкилом.
Название радикала зависит от количества атомов углерода в нем, для каждого из которых был предложен собственный корень. К корню добавляется суффикс –ил, тем самым образуя полное название радикала.
В таблице 1 представлено, какие корни используются для названия веществ, содержащих конкретное число атомов в углеродной цепочке.
Таблица 1. – Названия углеводородных заместителей

Для названия ряда алканов используется тот же метод, только вместо суффикса –ил, ставится суффикс –ан.

Представленный ряд веществ одного класса соединений называется гомологическим рядом (в нем каждый последующий элемент, называемый гомологом, отличается от предыдущего на 1 группу СН2).
Алгоритм названия алканов с заместителями
Чтобы назвать алкан, у которого есть один или несколько заместителей, следует придерживаться следующего алгоритма:
- Выбирается самый длинный участок углеродного скелета, и нумеруются атомы углерода.
- Нумерация, в соответствии с правилом, начинается с того конца, к которому заместитель ближе.Называть молекулу начинают с номера атома углерода, у которого стоит заместитель и его названия. Если одинаковых заместителей несколько, то сначала через запятые указываются номера атомов углерода, при которых стоит этот заместитель, а затем через дефис записывается число заместителя и его название. Числа записывают так, как указано в таблице 2.
- В соответствии с числом пронумерованных атомов углерода выбирается корень названия радикала.
- К концу корня приписывается суффикс –ан.
Таблица 2. – число и его запись при перечислении заместителей

Для примера назовем молекулу алкана в соответствии с алгоритмом.
Допустим, есть молекула, которая имеет вид:

- Находим самую длинную цепь и нумеруем атомы углерода в ней.

- Видим, что в молекуле есть заместители, смотрим: какие они и у каких атомов стоят. Видно, что у 2 и 8 атома стоят метил-радикалы, а у 5 атома – пропил-радикал.Записываем начало названия молекулы: 2,8-диметил-5-пропил.
- Теперь необходимо поставить корень и суффикс названия. Корень зависит от числа атомов углерода в цепочке. Здесь их 9, поэтому корень нон-. Так как у нас алкан, то суффикс – -ан.
- Запишем полное название:2,8-диметил-5-пропилнонан.
Галоген производные алканов
Галогенпроизводные алканов (их еще называют алкилгалонегидами) – вещества, у которых есть заместитель в виде атома галогена.
Более строгое понятие: алкилгалогенид – это углеводород, у которого 1 или более атомов водорода замещен на атом галогена.
Номенклатура галогенпроизводных алканов такая же, как и у алканов, только в качестве заместителя нужно указывать название галогена.
Например, названия веществ А и Б:2,3-дихлорбутан и 2-метил-3-хлорбутан.

Физические свойства алканов
Свойства алканов зависят от их структурного строения и количества атомов углерода в углеродном скелете. С их увеличением, агрегатное состояние меняется от газообразного до жидкого и твердого, а так же увеличивается плотность и температуры кипения и плавления, что отображено по таблицам ниже.
Рассмотрим физические свойства алканов.
По агрегатным состояниям алканы могут быть газами, жидкостями и твердыми веществами. Это зависит от длины углеродного скелета.
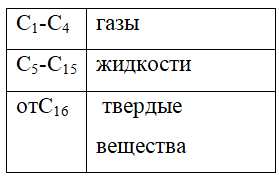
Следует отметить, что алканы хорошо растворимы в органических растворителях (например, в четыреххлористом углероде) и нерастворимы в воде. Алканы, имеющие строение разветвленного типа, обладают низкими температурами кипения, в отличие от линейных алканов.
Таблица температуры кипения алканов

Получение алканов
Некоторые алканы можно добывать напрямую из недр земли попутно с добычей нефти. В основном, так добывают метан. Недостаток этого способа – наличие загрязнений в газе, от которых довольно сложно избавиться, и к тому же для такой добычи нужно строить трубопроводы и другие установки для транспортировки.
Поэтому были предложены иные методы, которые позволили получать различные алканы с помощью химических реакций из других химических соединений.
Химические реакции способов получения алканов
Запомним, что в органической химии реакции записываются таким образом, чтобы слева были исходные органические компоненты, а справа продукт, который необходимо получить.
В отличие от неорганической химии, знак равенства между правой и левой частью уравнения не ставится, а заменяется стрелками. Это связано с тем, что в органической химии важно именно то, из какого вещества получился целевой продукт, при этом не так важно мольное соотношение компонентов. Коэффициенты можно встретить в случаях, когда, например, из 2 или 3 одинаковых молекул образуется одна новая.
Над стрелкой указываются условия, при которых происходит конкретная реакция. Это может быть температура, давление, неорганическое вещество или катализатор. Под стрелкой, со знаком «минус», указывается выделившийся побочный продукт химической реакции.
Теперь рассмотрим конкретно, с помощью каких реакций получают алканы.
- Реакции гидрирования алкенов:

Уточним, что гидрирование – это реакция присоединения органическим веществом водорода. Обычно, он присоединяется по кратной связи.
- Реакция Вюрца. Некоторые реакции являются именными, т.е. им присвоено имя ученого, который первым их предложил. При получении алканов данным методом в качестве реагента используется алкилгалогенид (т.е. органическое вещество, содержащее хлор, бром или иод в качестве заместителя). Реакция проводится под действием металлического натрия и при повышенной температуре. Побочным продуктом выделяется NaCl, и образуется алкан вида R-R:
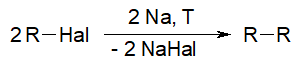
- Реакция восстановления галогенпроизводных алканов. Для получения алканов таким способом используется алкилгалогенид, который взаимодействует на железном катализаторе при высоких температурах с водородом. В результате этой реакции атом галогена в алкилгалогениде замещается на атом водорода. Побочным продуктом выделяется галогенводородная кислота.

- Реакция Дюма. При взаимодействии твердой соли карбоновой кислоты с твердой щелочью при нагревании выделяется газообразный алкан. В качестве побочного продукта образуется карбонат щелочного металла. Вспомним, что щелочные металлы – К, Na, Li, а газообразные алканы имеют в своем составе от 1 до 4 атомов углерода.

- Реакция электролиза. При проведении электрического тока через раствор соли карбоновой кислоты, выделяется алкан, и в качестве побочных продуктов образуются щелочь, углекислый газ и водород.

- Реакция Гриньяра. Для синтеза алканов таким способом используются определенные вещества, называемые реактивами Гриньяра, которое представляет собой радикал, соединенный с MgCl-группой. Реактив Гриньяра взаимодействует с алкилгалогенидом, в результате образуется алкан, длина цепи которого равна сумме атомов углерода у реактива Гриньяра и алкилгалогенида.

Определенные методы синтеза метана
Метан, в отличие от других алканов, можно получать и другими реакциями, которые рассмотрим ниже.
- Гидролиз карбида алюминия. Если чистый карбид алюминия опустить в воду, то начнет протекать необратимая реакция, в результате выделяется газообразный метан и образуется осадок гидроксида алюминия.

- Гидрирование углерода. Чистый углерод напрямую взаимодействует с водородом, но для этого необходимы условия: повышенная температура и использование катализатора из металлического никеля.
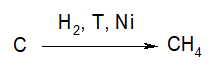
- Термокаталитическое восстановление оксидов углерода. Аналогично чистому углероду и при таких же условиях, его оксиды взаимодействуют с водородом, и также в результате реакции образуется метан. Побочным продуктом будет выделяться вода.

Химические реакции алканов
Алканы могут вступать в 2 типа химических реакций: замещения и разложения. Это вызвано тем, что алканы – насыщенные углеводороды и присоединить к себе другие вещества не могут, поскольку все связи заняты.
Рассмотрим химические свойства алканов реакциями, представленными ниже.
Реакции замещения
- Галогенирование. Реакция присоединения галогена (хлора, брома, иода), называется галогенированием. В результате данной реакции образуется алкилгалогенид и побочный продукт – галогенводородная кислота.

- Реакция Коновалова. При взаимодействии алкана с 10% раствором азотной кислоты образуется нитро-алкан и вода в качестве побочного продукта. Реакция проходит при повышенной температуре.

Реакции разложения
- Реакция полного горения. Под полным горением подразумевается, что вещество горит в избытке кислорода. При таком взаимодействии образуется углекислый газ и вода.

- Реакция неполного горения. Под неполным горением подразумевается, что вещество горит при недостатке кислорода. В результате такой реакции образуется угарный газ и вода.
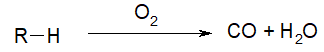
- Реакция полного дегидрирования. Дегидрирование – реакция разложения, в результате которой выделяется газообразный водород. Эта реакция характерна для алканов, которые по своему агрегатному состоянию являются газами. Реакция проходит под воздействием высоких температур. При полном дегидрировании выделяется чистый углерод (в виде сажи) и газообразный водород.

- Реакция неполного дегидрирования. Под воздействием окислителя оксида хрома (III) при высокой температуре алкан превращается в алкен.

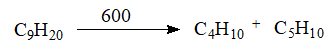
- Реакция крекинга. Крекинг – разложение углеводородов с большим числом атомов в углеродом скелете при высоких температурах и давлениях. Обычно, в результате крекинга образуется целая смесь газообразных углеводородов с меньшим количеством атомов углерода в цепочке.
Реакции окисления
- Реакции окисления метана. Под воздействием различных катализаторов метан может превращаться в метиловый спирт, формальдегид или метановую кислоту, о которых будет рассказано на последующих уроках. Катализатор в общем виде обозначается, как kat.

Применение алканов
Алканы используют в качестве топлива. Например, газовые плиты в квартирах работают при сжигании метана.
Из них делают резины и типографических краски, а так же получают синтетический бензин.
Как было рассмотрено выше, алканы являются сырьем для производства других органических соединений, т.е. участвуют в цепочке органического синтеза.
Также алканы используют для получения парафиновых свечей и веществ, позволяющих поддерживать холод в морозильных камерах.

ВОПРОСЫ И ЗАДАНИЯ
Формула для описания молекулы алкана имеет вид:
1) СnH2n 2) СnH2n-2 3) СnH2n+2 4) СnH2n+1
Для алканов НЕ характерны реакции
1) Соединения 2) Разложения 3) Горения 4) Окисления
При взаимодействии карбида алюминия с водой образуется алкан, который называется:
1) Этан 2) Метан 3) 2,8-диметил-5-этилнонан 4) Декан
В молекулах алкана, атомам углерода характерен тип гибридизации:
1) sp2 2) sp 3) sp3 4) Атомы углерода не гибридизованы
При получении алканов по реакции Вюрца следует повышать температуру и использовать:
1) Титан 2) Никель 3) Серебро 4) Натрий




